Белорусско-Российский университет
Кафедра "Физика"
О.Е.Коваленко
1.3 Массовое и зарядовое числа
Для характеристики атомных ядер вводится ряд обозначений. Число протонов, входящих в состав атомного ядра, обозначают символом Z и называют зарядовым числом или атомным номером (это порядковый номер в периодической таблице Менделеева).
Поскольку атом нейтрален, то заряд ядра определяет число электронов в атоме, от которого зависит их распределение по состояниям в атоме, от которого зависит их распределение по состояниям в атоме, а следовательно, зависят химические свойства атома.
Заряд ядра равен Ze, где e – элементарный заряд. Число нейтронов обозначают символом N.
Общее число нуклонов (т. е. протонов и нейтронов) называют массовым числом A:
|
A = Z + N. |
Ядра химических элементов обозначают символом 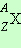 , где X – химический символ элемента. Например,
, где X – химический символ элемента. Например, – водород,
– водород,  – гелий,
– гелий,  – углерод,
– углерод,  – кислород,
– кислород,  – уран.
– уран.
Ядра одного и того же химического элемента могут отличаться числом нейтронов. Такие ядра называются изотопами. У большинства химических элементов имеется несколько изотопов. Например, у водорода их три:  – обычный водород,
– обычный водород, 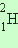 – дейтерий и
– дейтерий и ![]() – тритий. У углерода – 6 изотопов, у кислорода – 3.
– тритий. У углерода – 6 изотопов, у кислорода – 3.
Химические элементы в природных условиях обычно представляют собой смесь изотопов. Существование изотопов определяет значение атомной массы природного элемента в периодической системе Менделеева. Так, например, относительная атомная масса природного углерода равна 12,011.
Изобарами называются ядра с одинаковым массовым числом A, но разными Z. Например, ![]() .
.
Изотонами называются ядра с одинаковым числом нейтронов N = A − Z. Например, ![]() .
.
Наряду с термином ядро атома часто используется также термин нуклид.
Самым тяжелым из имеющихся в природе элементов является изотоп урана ![]() . Элементы с атомными номерами больше 92 называются трансурановыми. Все они получены искусственно в результате различных ядерных реакций.
. Элементы с атомными номерами больше 92 называются трансурановыми. Все они получены искусственно в результате различных ядерных реакций.
Размер ядра характеризуется радиусом ядра, имеющим условный смысл ввиду размытости границ ядра. Эмпирическая формула для радиуса ядра
![]()
где R0 =(1,3÷1,7)10-15 м, может быть истолкована как пропорциональность объема ядра числу нуклонов в нем. Следовательно, плотность ядерного вещества примерно одинакова для всех ядер (≈1017 кг/м3).
 Элементы физики атомного ядра и элементарных частиц
Элементы физики атомного ядра и элементарных частиц 1.1 Опыт Резерфорда. Ядерная модель атома. Заряд, размер, масса атомного ядра
1.1 Опыт Резерфорда. Ядерная модель атома. Заряд, размер, масса атомного ядра